大阪医科薬科大学 薬学部 病態生化学研究室Department of Pathobiochemistry, Faculty of Pharmacy
Osaka Medical and Pharmaceutical University

研究内容
はじめに
脂質メディエーター(lipid mediator)とは・・・
脂質(脂肪酸)は、生体膜の構成成分やエネルギー源としてのはたらき以外に、外界からの様々な刺激により産生され、多様な生理機能を発揮するはたらきがあります。このように生理機能をもつ脂質(生理活性脂質)を、特に「脂質メディエーター」といいます。脂質メディエーターの代表的なものとしては、プロスタグランジン(prostaglandin: PG)、ロイコトリエン(leukotriene: LT)、血小板活性化因子(platelet-activating factor、PAF)やリゾホスファチジン酸(lysophosphatidic acid、LPA)などがあります。
脂質メディエーターの一つであるプロスタグランジンは、5員環をもつ炭素数20からなるプロスタン酸を基本骨格とした構造からなります。プロスタグランジンには、5員環の酸化状態や側鎖部分の二重結合の位置の違いから、PGE2, PGD2、PGF2αやPGI2があります。また、プロスタグランジンとトロンボキサンA2を合わせてプロスタノイド(prostanoid)といいます。また、アラキドン酸から産生される生理活性脂質を総称してエイコサノイド(eicosanoid)といい、プロスタグランジン、トロンボキサンおよびロイコトリエンが含まれます(図)。
プロスタグランジンの生合成は、細胞膜のリン脂質がホスホリパーゼにより加水分解されてアラキドン酸が生成される反応から始まります。アラキドン酸はシクロオキシゲナーゼ(cyclooxygenase: COX)によってプロスタグラジン類の生合成のための共通の中間体であるPGH2に変換され、それぞれのプロスタグランジンはプロスタグランジン最終合成酵素により合成されます。プロスタグランジンは、「必要な時に」、「必要な場所で」、「必要なだけ」、産生されることから、「局所ホルモン」と呼ばれることがあります。プロスタグランジンは、生合成した細胞自体あるいは近傍の細胞の細胞膜に存在するGタンパク質共役受容体であるプロスタグランジン受容体に結合することにより、様々な生理作用を発揮します。
アスピリンなどの非ステロイド性抗炎症薬(nonsteroidal anti-inflammatory drugs: NSAIDs)は、プロスタグランジン類、特に発痛を増強する作用を有するPGE2の生合成に関わる酵素であるCOXの活性を阻害することにより痛みを抑えます。一方で、アスピリン潰瘍という言葉があるように、アスピリンは消化管のプロスタグランジンの産生も止めてしまうため、消化管膜の保護に必要なプロスタグランジンの産生を抑えてしまい、消化管障害などの副作用が現れることがあります。このように、プロスタグランジンは、体の中で様々な生理作用を発揮し、その作用は、時には体にとって有利にはたらきますが、一方で不利にはたらくこともあります。そのはたらきは、体の中の場所(臓器、組織、細胞)によって異なるとされます。
ロイコトリエンは、白血球(ロイコサイト)から産生される3つの二重結合(トリエン)をもつ物質であることから命名されました。アラキドン酸が核膜に局在する5-リポキシゲナーゼによりロイコトリエンA4(LTA4)に変換され、さらにLTB4やLTC4などが生合成されます。ロイコトリエンはプロスタグランジンと同様に、細胞膜に局在するGタンパク質共役型受容体であるロイコトリエン受容体に結合し、気管支平滑筋収縮、血管拡張や血管透過性亢進や好酸球増加などの生理作用を発揮します。
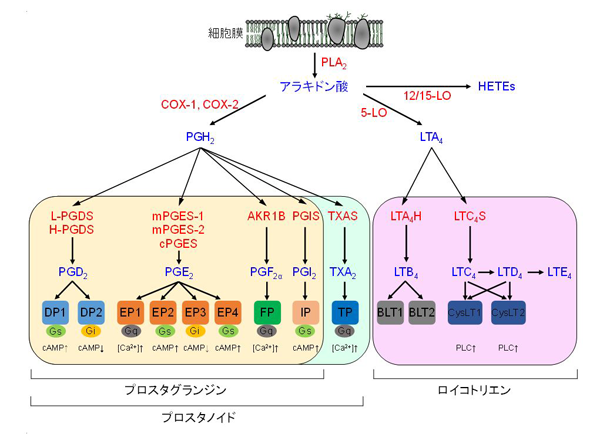
エイコサノイドの生合成経路
主な研究内容
- 脂質メディエーターの生理機能と産生制御機構に関する研究
- 生活習慣病の成り立ちとその制御機構に関する研究
- 神経細胞の障害保護効果を有する物質の同定とその制御機構に関する研究
- 肥満抑制効果をもつ天然物由来成分の探索とその作用機構に関する研究
- マクロファージの活性化制御に関する研究
脂質メディエーターの生理機能と産生制御機構に関する研究
脂質メディエーターは、「必要な時に」、「必要な場所で」、「必要な量だけ」産生され、様々な生理機能を調節しています。そのはたらきは極めて微量で発揮されます。このように、脂質メディエーターが、強力で、かつ体の中で様々な生理機能を調節することから、その産生制御は極めて厳密であると考えられていますが。しかしながら、いまだ不明な点がたくさんあります。
私たちは、これまでにプロスタグランジンを合成する酵素の遺伝子発現調節機構を解析し、遺伝子発現調節からプロスタグランジンの産生調節機構を明らかにしてきました。また、合成されたプロスタグランジン合成酵素が、プロスタグランジン産生終了後に速やかに分解されることを明らかにしました。現在、脂質メディエーターの生理機能とその産生制御機構の解明を目指し、プロスタグランジンの産生を調節する新たな分子を同定し、その調節機構の解析を行っています。
主な参考論文
- Yazaki et al., Mol. Biol. Cell 23: 12-21 (2012)
- Fujimori et al., Gene 426: 72-80 (2008)
- Fujimori et al., Gene 397: 143-152 (2007)
- Fujimori et al., J. Biol. Chem. 280: 18452-18461 (2005)
- Fujimori et al., J. Biol. Chem. 278: 6018-6026 (2003)
- Fujimori et al., J. Biol. Chem. 275: 40511-40516 (2000)
生活習慣病の成り立ちとその制御機構に関する研究
我が国では生活習慣病を発症している人の数は増加の一途をたどっています。糖尿病の患者数は300万人を超えており、高血圧症では1,000万人を超える患者がいるとされます(厚生労働省)。特に、中高年の多くの人は何らかの生活習慣病をもっており、それが将来重大な健康障害を引き起こす可能性が指摘されています。これらの生活習慣病の発症原因の一つとして肥満が挙げられます。肥満は、日常の様々な不健康、不規則な生活習慣が原因となって発症するとされます。先進国では日常的な栄養過多や運動不足により肥満となり、肥満に起因する健康上の問題が深刻な社会問題となっています。生活習慣病を発症させないためには、肥満を予防・解消することが重要であるとされます。
私たちは、脂質代謝異常疾患、肥満をはじめとする生活習慣病の発症・進展制御における脂質メディエーターや脂肪酸の役割に注目しています。脂質メディエーターの一つであるプロスタグランジンなどのエイコサノイドによる脂肪細胞の分化制御(肥満制御)の分子機構を明らかにし、さらに遺伝子改変動物などを用いた解析も行っています。これまでに、PGD2やその代謝物が肥満の制御に関わることを発見しました。また、PGE2とPGF2αが協調して脂肪細胞の初期分化を抑制することが分かりました。「脂質メディエーターの産生調節による肥満制御機構の解明」を行い、脂質メディエーターの産生を制御する薬剤を開発し、肥満の予防や解消を目指しています。
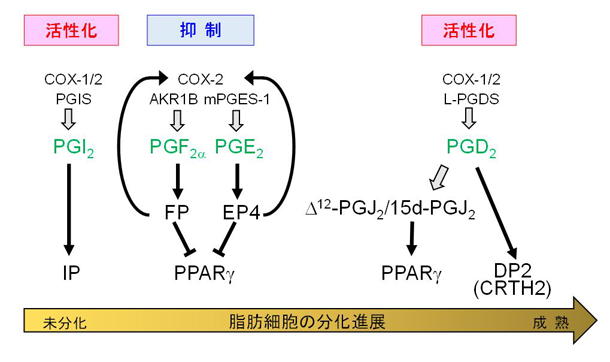
脂肪細胞の分化制御におけるプロスタグランジンの役割
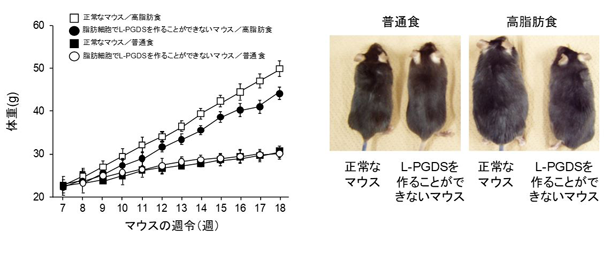
脂肪細胞特異的リポカリン型PGD合成酵素(L-PGDS)遺伝子欠損マウスは
食事性肥満の制御に関わる
主な参考論文
- Fujimori et al., Biochim. Biophys. Acta Mol. Cell Res. 1869: 119203 (2022)
- Fujimori, Biol. Pharm. Bull. 45: 985–991 (2022)[Review]
- Fujimori et al., Sci. Rep. 9: 1931 (2019)
- Wakai et al., Biochem. Biophys. Res. Commun. 490: 393-399 (2017)
- Gambo et al., Mol. Cell. Endocrinol. 431: 1-11 (2016)
- Fujimori et al., Methods in Mol. Biol. 1164: 177-196 (2014)
- Fujimori et al., Mol. Cell. Endocrinol. 384: 12-22 (2014)
- Yuyama et al., Biochem. J. 459: 489-503 (2014)
- Kobayashi et al., Am. J. Physiol. Endocrinol. Metab. 302: E1461-E1471 (2012)
- Fujimori et al., PLoS ONE 7: e44698 (2012)
- Fujimori et al., Gene 505: 46-52 (2012)
- Fujimori et al., PPAR Res. 527607 (2012) [Review]
- Ueno et al., FEBS J. 278: 2901-2912 (2011)
- Fujimori et al., Prostaglandins Other Lipid Mediat. 93: 52-59 (2011)
- Fujitani et al., FEBS J. 277: 1410–1419 (2010)
- Fujimori et al., J. Biol. Chem. 285: 8880-8886 (2010)
- Fujimori et al., J. Biol. Chem. 282: 18458-18466 (2007)
- Fujitani et al., J. Biol. Chem. 275: 40511-40516 (2000)
神経細胞の障害保護効果を有する物質の同定とその制御機構の解明
脳の神経細胞は、一般に、再生する能力がほとんどないといわれています。私たちの体は常に様々なストレスにさらされており、そのストレスを防御する機構をもち合わせてはいるものの、そのストレスが過剰である場合、細胞や組織に損傷を及ぼします。たとえば、神経変性疾患であるパーキンソン病やアルツハイマー病を発症すると、神経変性、神経細胞死が進行し、それに伴って様々な脳機能障害が現れます。多くの神経変性疾患は未だ治療法が確立されておらず、高齢化社会が進むにあたり、中枢神経系疾患の治療手段を開発することは重要です。
私たちは、神経細胞の細胞死を保護する因子を探索し、これまでに、PGF2αが6-ヒドロキシドパミンによって誘導される神経細胞死を抑制することを見出しました。
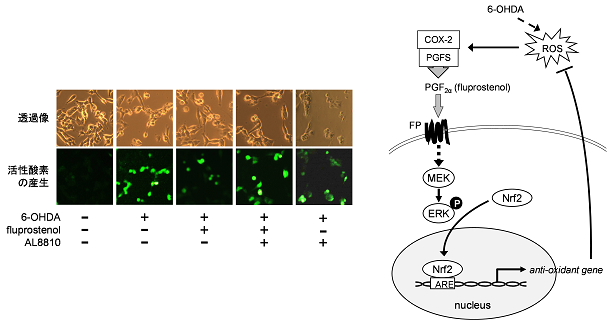
PGF2αは、6-ヒドロキシドパミン(6-OHDA)から生成される活性酸素による神経細胞死を抑制する
また、神経細胞保護作用を有する天然物由来成分を探索し、フラボノイド類が神経細胞のアポトーシスを抑制することを発見しました。
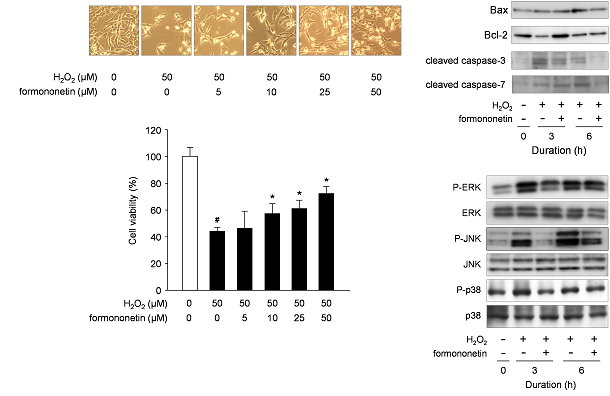
フラボノイドであるフォルモノネチンは、活性酸素による神経細胞死を抑制する
主な参考論文
- Sano et al., Toxicology 450: 152686 (2021)
- Sugimoto et al., Neurotoxicology 85: 186-200 (2021)
- Watanabe et al., Neurochem. Res. 43: 488-499 (2018)
- Fujimori et al., J. Neurochem. 120: 279-291 (2012)
- Fukuhara et al., Biochem. J. 443: 75-84 (2012)
- Suematsu et al., Neurosci. Lett. 504: 223-227 (2011)
肥満抑制効果をもつ天然物由来成分の探索とその作用機構の解明
多くの人は肥満を大きな問題として捉えておらず、ほとんどの場合、体型(見た目)を気にするところでとどまってしまいます。実際、肥満だけが原因で死に至ることはまれですが、恐ろしいのは、肥満が原因となって発症する糖尿病、高血圧症や脳や心臓の血管系の疾患などの生活習慣病です。これら生活習慣病は、ある日突然に発症するものではなく、長い時間をかけて形成されるものです。多くの場合、時間をかけて発症する疾患は、その治癒、解消までに長い時間を要します。このようなことから、肥満を解消する一つの手段として、低分子化合物の薬剤(抗肥満薬)と比べて作用は緩やかですが、安全性が高いとされる天然物由来成分に注目しています。
私たちは、肥満を制御する天然物由来成分の探索を行い、その効果や作用機序の解明を行っています。これまでに、果実、果皮や種子に含まれる天然物由来成分に肥満(脂肪細胞分化)抑制効果があることを見出し、その作用機序を明らかにしてきました。
熱帯植物であるアンディローバ(Carapa guianensis, Meliaceae)の種子中に含まれるリモノイドである7-deacetoxy-7-oxogedunin(CG-1)が、食餌性肥満を抑制し、インスリン感受性の改善と褐色脂肪細胞を活性化することを見出しました。
私たちは、天然物由来成分の抗肥満あるいは肥満解消効果を科学的根拠に基づいて明らかにし、有用天然物由来成分を含む野菜や果実などの食品の新たな価値の発見、また有用天然物由来成分の食品添加物としての応用を目指して研究をしています。
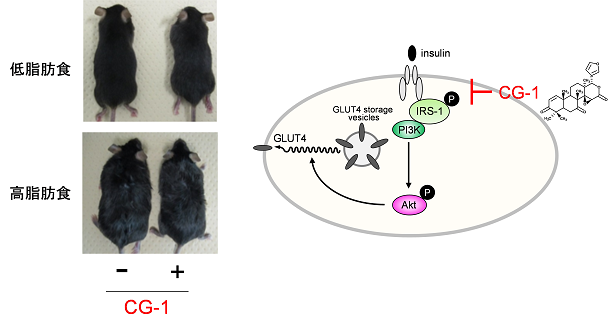
熱帯植物アンディローバ由来リモノイドCG-1は肥満を抑制する
主な参考論文
- Yamamoto et al., Chem. Biol. Interact. 346: 109595 (2021)
- Matsumoto et al., J. Agric. Food Chem. 67: 10107-10115 (2019)
- Matsumoto et al., Molecules 9: 1668 (2019)
- Nagai et al., Nutrients 10: nutrients-240954 (2018)
- Baba et al., J. Agric. Food Chem. 64: 9607-9615 (2016)
- Nakao et al., PLoS ONE 11e0163640 (2016)
- Nagai et al., J. Funct. Foods 22: 490-503 (2016)
- Watanabe et al., J. Agric. Food Chem. 63: 4979-4987 (2015)
- Fujimori et al., J. Agric. Food Chem. 61: 5139-5147 (2013)
- Ono et al., J. Agric. Food Chem. 59: 13346-13352 (2011)
マクロファージの活性化制御に関する研究
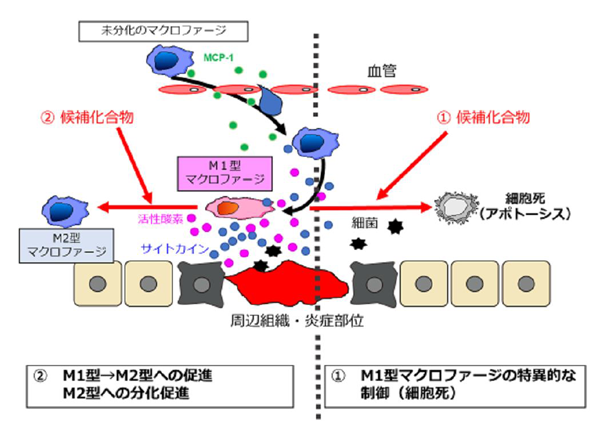
マクロファージは、感染初期において病原体の排除を行うだけでなく、組織の恒常性の維持など、体の中で様々なはたらきをしています。なぜマクロファージにはこのような多岐にわたるはたらきがあるのでしょうか。マクロファージは、病原体によって刺激されるだけでなく、周辺環境からの刺激や細胞内で生成された代謝産物によっても刺激をうけます。この刺激の種類に応じて、未分化のマクロファージからM1型(炎症促進)あるいはM2型(炎症抑制・組織修復)のマクロファージに分化します。その結果、時には病原体の排除を行い、時には組織の修復にはたらいたりします。
通常、M1型とM2型のマクロファージのバランスが保たれています。しかし、このバランスが破綻し、M1型が優位になると炎症が進展します。免疫系や代謝系の異常によってM1型優位が持続すると炎症状態が悪化し、その結果、動脈硬化症や糖尿病、自己免疫疾患などの炎症関連疾患が増悪することが知られています。つまり、これらの炎症関連疾患において、M1型とM2型のバランスを正常化、あるいはM1型およびM2型マクロファージのバランスをM2型優位にすることは、炎症性疾患の治療において重要です。
私たちはM1型とM2型のバランスを正常化する、あるいはM2型への分化を促進する作用をもつ化合物の探索を進めています。具体的に、以下の2つの方向性で研究を展開しています。1つ目はM1型マクロファージだけを制御(細胞死を誘導する)し、M1型を減らすことで炎症を鎮静化させます。2つ目はM1型マクロファージをM2型に変換する、あるいはM2型への分化を促進させ、炎症抑制作用を亢進させます。私たちは、このような作用を有する化合物のスクリーニングを進め、同定した候補化合物の分子制御機構の解明も行っています(Koike et al., 2016)。本研究で得られた成果をもとに、M1型とM2型のマクロファージのバランスの正常化、およびM2型マクロファージへの分化を促進する、マクロファージの制御を目的としたユニークな抗炎症薬の開発を目指しています。
主な参考論文
- Koike et al., Eur. J. Pharmacol. 972: 176572 (2024)
- Koike et al., FEBS J. 288: 4249-4266 (2021)
- Kawakami et al., J. Biochem. 527: 49-55 (2020)
- Koike et al., Exp. Cell Res. 380: 171-179 (2019)
- Koike et al., Biol. Pharm. Bull. 39: 969-976 (2016)
- Koike et al., Biol. Pharm. Bull. 37: 1617-1625 (2014)
